Les fleurs, les légumes, les fruits et, d'une manière générale, les plantes ayant une couleur (autre que le vert de la chlorophylle) renferment des molécules qui sont responsables de cette couleur. Certaines de ces molécules sont sensibles à leur environnement chimique et leur couleur peut ainsi varier, comme des indicateurs colorés.
C'est le cas des anthocyanines, famille de colorants naturels (les flavonoïdes) dont la couleur varie sur tout le spectre coloré (selon les groupements présents sur le squelette de base) et en fonction du pH de la solution, c'est à dire de son acidité ou, au contraire, de son alcalinité (basicité).
On parle alors d'indicateur de pH. Le légume le plus représentatif est certainement le chou rouge.
Nous utilisons le jus de chou rouge pour illustrer la variation de couleur en fonction du pH. On pourrait d'ailleurs s'étonner que ce chou soit appelé rouge, alors qu'il est violet ! Et nous allons voir qu'il peut prendre toutes les couleurs !
Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes :
Mettre à chauffer 1 L d'eau (si possible distillée) dans une casserole.
Couper la moitié d'un chou rouge en plusieurs morceaux et les mettre dans l'eau.
Lorsque l'eau arrive à ébullition, arrêter de chauffer.
Retirer les bouts de chou rouge, filtrer la solution à l'aide d'un filtre à café et verser le filtrat dans une bouteille pouvant être fermée hermétiquement.
Le jus de chou rouge peut être conservé plusieurs mois au réfrigérateur, dans sa bouteille fermée, sans subir de dégradation ni dégager de mauvaise odeur de chou.

Verser environ 5 mL de jus de chou rouge obtenu précédemment dans 9 tubes à essai identiques.
Diluer de moitié le contenu de chaque tube en ajoutant 5 mL d'eau. La couleur devrait être bleue. (Si ce n'est pas le cas, l'eau utilisée est peut-être légèrement acide ou basique ; ce n'est pas important pour la suite des expériences.)
Effectuer les tests suivants :
Tube 1 : ne rien y ajouter ! Il s'agit du tube de la couleur de référence, "neutre", du chou rouge. La couleur est normalement bleue.
Tube 2 : ajouter une ou deux gouttes de jus de citron et mélanger. La couleur vire au rose-violet.
Tube 3 : ajouter une ou deux gouttes d'acide éthanoïque , ou de vinaigre d'alcool. La couleur vire au rose fuchsia.
Tube 4 : ajouter une ou deux gouttes d'acide chlorhydrique . La couleur vire au rouge.
Tube 5 : ajouter une dizaine de goutte d'acide chlorhydrique . Constater que la couleur reste rouge et n'évolue plus quand on ajoute encore de l'acide.
Tube 6 : ajouter une pincée d'hydrogénocarbonate de sodium et agiter. La couleur devient bleu-turquoise.
Tube 7 : ajouter une goutte d'ammoniaque . La couleur devient d'un vert vif.
Tube 8 : ajouter une goutte d'une solution d'hydroxyde de sodium . La couleur devient jaune-vert.
Tube 9 : ajouter plusieurs gouttes d'une solution d'hydroxyde de sodium . Constater que la couleur devient jaune vif et n'évolue plus quand on ajoute encore de la soude.
On peut se demander si les couleurs peuvent être réversibles. Pour cela effectuer les tests suivants :
Tube 10 : ajouter une ou deux gouttes de vinaigre d'alcool. La couleur devient rose fuchsia. Dans ce même tube, ajouter quelques gouttes d'ammoniaque et constater que la couleur revient au bleu, puis devient d'un vert vif. Toujours dans ce tube, ajouter du vinaigre d'alcool et constater que la couleur peut repasser au bleu, puis au rose.
Enfin, un test amusant consiste à souffler avec une paille dans un récipient contenant du jus de chou rouge, de manière à faire des bulles. Après quelques expirations, la couleur initialement bleue ou violette vire vers le rose (explications ci-après).
un pH = 7 est celui d'une solution neutre (à 25°C),
un pH < 7 est dit acide,
un pH > 7 est dit basique.
Les anthocyanines (ou anthocyanes) sont des molécules sensibles à la présence des ions H₃O+ et HO-, et par conséquent à la valeur du pH de la solution dans laquelle elles se trouvent.
Avec le jus de chou rouge, il est possible de fabriquer une échelle de couleur très variée en fonction du pH, mesuré par exemple avec un pH-mètre. On peut ainsi utiliser un produit naturel et à bas prix pour quelques analyses élémentaires de pH.
La couleur vue par notre oeil est en réalité celle qui n'est pas absorbée par la molécule lorsqu'elle est éclairée par une lumière blanche (lumière du soleil), c'est à dire la couleur complémentaire. Si la molécule absorbe majoritairement la couleur rouge, notre oeil verra la couleur complémentaire : le vert.
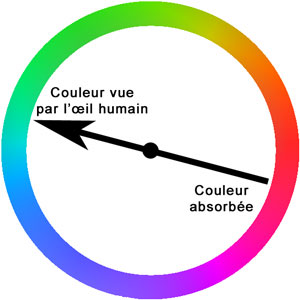
La couleur absorbée par une molécule dépend de la différence d'énergie qui existe entre l'état fondamental (de plus basse énergie) et les premiers états excités. En fonction du pH, la répartition des électrons dans la molécule est modfiée, ce qui implique une modification d'énergie des états, fondamental et excités, de la molécule. (La compréhension de ces notions fait appel à la mécanique quantique.)
Dans une certaine gamme de pH, la passage de la molécule d'une forme à une autre est réversible, ce qui explique pourquoi on peut revenir à la couleur initiale en ajoutant un produit d'acidité contraire. Par contre si le pH est trop basique (couleur jaune), la structure de la molécule est modifiée (réaction chimique) et la réversibilité n'est plus possible.
Le test avec les acides et bases utilisées ci-dessus permet de conclure :
Il est alors possible de tester d'autres solutions aqueuses pour connaître leur pH : eau distillée, eau de mer, eau de piscine, eau gazeuse, eau savonneuse, eau de Javel, salive, urine, larmes, produit anti-calcaire... (à condition que ces solutions ne soient pas trop colorées elles-mêmes.) Mais alors, que se passe-t-il pour le changement de couleur observé lorsque l'on souffle dans le jus avec une paille ? La raison est que l'air expiré de nos poumons s'est chargé en gaz carbonique (ou dioxyde de carbone CO₂) : c'est un gaz qui possède un caractère faiblement acide dans l'eau.
Ce principe est celui utilisé pour le papier pH.
wiki science amusante: